Introducción
El cáncer renal, al igual que otros tumores de la vía urinaria, es diagnosticado y tratado por la especialidad de urología. Su frecuencia ha incrementado importantemente y debido a sus manifestaciones, principalmente la hematuria, constituye un motivo frecuente de consulta nefrológica. Se han descrito una serie de factores que participan en la generación de tumores y cánceres renales, más recientemente cobran importancia en población adulta los efectos de la contaminación por exposición a metales pesados, mientras que los tumores de origen embrionario siguen afectando de una manera significativa la calidad de vida de los pacientes pediátricos e impactan en la supervivencia. El nefrólogo deberá contar con el conocimiento competente para diagnosticar los tumores renales y tratarlos o, en su caso, referirlos de manera pronta al urooncólogo1–3.
Diagnóstico
Inicialmente cursa de manera asintomática, la tríada clásica del internista en pacientes adultos se puede presentar hasta en el 20% de los casos (dolor en fosa renal, masa palpable lumbar o abdominal y hematuria silenciosa), lo cual denota un problema avanzado. En la mayoría de las ocasiones es por incidentaloma (hallazgo fortuito del tumor), en el transcurso de la realización de otros estudios por causas no renales4,5.
La exploración física
Puede demostrar masa abdominal palpable de diferentes dimensiones, indolora, adenopatía, varicocele y edema de extremidades inferiores. Existen manifestaciones sistémicas que constituyen síndromes paraneoplásicos y pueden ocurrir hasta en el 30% de los casos; pueden iniciar con síntomas de afectación metastásica en donde el dolor óseo es persistente y la tos es frecuente. En otros casos, llaman la atención diversas afecciones sistémicas inmersas en un síndrome paraneoplásico.
Síndromes paraneoplásicos: hipertensión arterial, caquexia, pérdida de peso, fiebre, neuromiopatía, amiloidosis, velocidad de sedimentación globular incrementada, anemia, pruebas de función hepática alteradas, hipercalcemia y policitemia4,5.
Estudios de laboratorio
Será necesario determinar los calores de creatinina sérica, tasa de filtración glomerular, hemoglobina, velocidad de sedimentación globular, fosfatasa alcalina, deshidrogenasa láctica y valor de calcio sérico3,4.
Estudios de imagen
El ultrasonido renal es útil en presencia de daño renal que impida la aplicación de medio de contraste. Los estudios de tomografía y resonancia magnética permiten identificar con mayor precisión la masa tumoral, la morfología renal, extensión de la neoplasia, extensión a vasos sanguíneos, adenopatías regionales y valorar otros órganos para descarar la presencia de metástasis, clasificar y estratificar el tipo de tumor (Tabla 1).
Tabla 1. Estadificación del cáncer renal de acuerdo con la clasificación TNM
| T: tumor primario | |||
| TX: No se puede evaluar el tumor primario | |||
| T0: Ausencia de datos de tumor primario | |||
| T1: Tumor ≤ 7 cm de diámetro limitado al riñón | |||
| T1a Tumor: ≤ 4 cm de diámetro limitado al riñón | |||
| T1b Tumor: ≤ 4 y < 7 cm de diámetro limitado al riñón | |||
| T2 Tumor: > 7 cm de diámetro limitado al riñón | |||
| T2a Tumor: > 7 y < 10 cm de diámetro limitado al riñón | |||
| T21b Tumor: > 10 cm de diámetro limitado al riñón | |||
| T3: El tumor se extiende a venas, invade glándula suprarrenales y grasa perirrenal, sin tomar la glándula ipsilateral y no sobrepasa la fascia de Gerota | |||
| T3a: El tumor se extiende a la vena renal o sus ramas (incluye músculo) o invade grasa perirrenal y no sobrepasa la fascia de Gerota | |||
| T3b: El tumor se extiende a la vena cava por debajo del diafragma | |||
| T3c: El tumor se extiende a la vena cava por arriba del diafragma o toma la pared de la vena cava | |||
| T4: El tumor invade sobrepasando la fascia de Gerota, incluida la glándula suprarrenal ipsilateral | |||
| N: ganglios linfáticos regionales | |||
| NX: No se pueden evaluar los vasos linfáticos regionales | |||
| N0: Ausencia de metástasis ganglionares regionales | |||
| N1: Metástasis en un solo ganglio linfático regional | |||
| N2: Metástasis en más de un ganglio linfático regional | |||
| M: metástasis | |||
| M0: Ausencia de metástasis a distancia | |||
| M1: Presencia de metástasis a distancia | |||
| Agrupación por estadios | |||
| Estadio I | T1 | N0 | M0 |
| Estadio II | T2 | N0 | M0 |
| Estadio III | T3 | N0 | M0 |
| T1, T2, T3 | N1 | M0 | |
| Estadio IV | T4 | Cualquier T | M0 |
| Cualquier T | N2 | M0 | |
| Cualquier T | Cualquier T | M1 | |
|
Adaptada de Msaouel et al.10 |
|||
Métodos complementarios
La arteriografía renal y la flebografía de la vena cava inferior son útiles para identificar afección venosa o arterial, complicaciones derivadas de fenómenos trombóticos y para la planeación de embolización terapéutica.
Otros estudios estarán dados a criterio clínico, según el objetivo de estudio y prioridad del protocolo de extensión. La telerradiografía posteroanterior de tórax, gammagrama óseo y tomografía cerebral son útiles en búsqueda de lesiones metastásicas, sobre todo si hay síntomas o signos de tal afección6–8.
Es común encontrar quistes renales en el estudio de la función renal a los cuales no debe restarse importancia, ya que las masas renales quísticas se relacionan con incremento del riesgo de cáncer renal. Estas alteraciones aparentemente benignas tienen el potencial de complicarse desarrollando sangrado, dolor, infección y cáncer, este último se habrá que sospechar ante cambios de imagen en el control tomográfico (Fig. 1). Los quistes se clasifican en cinco categorías en función del aspecto tomográfico. La Clasificación de Bosniak ha correlacionado la morfología de las lesiones con el riesgo de malignidad, y, a su vez, establece recomendaciones terapéuticas (Tabla 2). La figura 1 muestra un quiste renal de grandes dimensiones con imágenes de alta densidad en su interior que obligan a descartan cáncer renal.
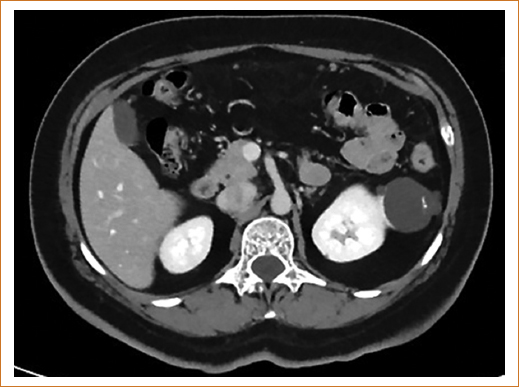
Figura 1. Corte tomográfico abdominal que muestra quiste degenerado.
Tabla 2. Clasificación de Bosniak de los quistes renales
| Categoría de Bosniak | Características | Actitud |
|---|---|---|
| I | Quiste benigno simple con una pared muy fina o delgada que no contiene tabiques, calcificación ni componentes sólidos. Tiene densidad de agua y no se realza con el material de contraste | Benigno |
| IIF | Quiste benigno que puede contener algunos tabiques muy finos o delgados. Puede haber calcificación fina en la pared o los tabiques. Lesiones < 3 cm con una atenuación alta de manera uniforme, de bordes bien definidos y que no se realzan con el contraste | Benigno |
| III | Estos quistes pueden contener más tabiques muy finos o delgados. Puede observarse un realce mínimo de un tabique muy fino o delgado o de la pared con el contraste. Puede haber un engrosamiento mínimo de los tabiques o la pared. El quiste puede contener calcificación, que puede ser nodular y gruesa, pero no hay realce con el contraste. No hay elementos de tejidos blandos que se realcen con el contraste. En esta categoría también se incluyen lesiones renales ≥ 3 cm totalmente intrarrenales, que no se realzan con el contraste y de atenuación elevada. Estas lesiones presentan, en general, unos bordes bien definidos | Seguimiento Una pequeña proporción son malignos |
| IV | Estas lesiones son masas quísticas indeterminadas que presentan paredes o tabiques irregulares engrosados en los que puede observarse realce con el contraste | Cirugía o seguimiento Malignos en más del 50% de las lesiones |
| V | Estas lesiones son lesiones quísticas claramente malignas que contienen componentes de tejidos blandos que se realzan con el contraste | Tratamiento quirúrgico recomendado Tumor maligno en la mayoría de los casos |
Biopsia renal
La biopsia renal constituye una herramienta diagnóstica excelente, sin embargo, requiere insumos específicos e infraestructura, por demás, recursos suficientes para su estudio (diferentes tinciones, análisis inmunohistoquímico, diversos procesamientos microscópicos y otros). Un 10 a 20% de las biopsias no son concluyentes en la identificación del diagnóstico. El análisis histopatológico es elemental en la determinación de la estirpe histológica y del comportamiento inmunohistoquímico, que actualmente guarda una correlación directa con la selección de la terapia inmunosupresora y del pronóstico. El sistema de clasificación de Fuhrman del grado nuclear en el cáncer renal es la clasificación más aceptada9,10.
Según la Organización Mundial de la Salud, hay al menos tres subtipos histológicos principales de cáncer renal:
- – Células claras (80-90%)
- – Papilar (10-15%)
- – Células cromófobas (4-5%)
Otros tumores renales: estudios morfológicos con uso de técnicas inmunohistoquímica y moleculares contemporáneas han dado lugar a la clasificación actual de las neoplasias epiteliales renales. Los tipos habituales no cambian en frecuencia, sin embargo existe un grupo de alteraciones que comprenden diversos carcinomas esporádicos y familiares infrecuentes, y otros más no clasificados9.
- – Cáncer renal sarcomatoideo
- – Cáncer renal no clasificado
- – Cáncer renal de células clara multilocular (quístico multilocular)
- – Adenoma papilar
- – Carcinoma medular renal
- – Carcinoma por translocación
- – Carcinoma mucinoso y tubular de células fusiformes
- – Carcinoma asociado a nefropatía terminal
Tumores metanéfricos
Se dividen en adenoma metanéfrico, adenofibroma y tumores del estroma metanéfrico. Se trata de tumores benignos, raros y su extirpación quirúrgica resulta suficiente.
Tumores epiteliales y estromales renales
Los tumores epiteliales y estromales renales representan un nuevo concepto que combinados tumores mesenquimatosos y epiteliales mixtos benignos: nefroma quístico y tumores epiteliales y estromales mixtos. Los estudios de imagen revelan que la mayoría de las lesiones quísticas corresponden al tipo III de Bosniak y, con menor frecuencia, al tipo II o IV. Aunque se ha descrito un comportamiento agresivo en muy pocos casos, ambas neoplasias suelen considerarse benignas y la resección quirúrgica, curativa.
Oncocitoma
Los oncocitomas renales son tumores benignos, representan el 3 a 7% de los tumores renales. También se identifican células oncocitósicas en el cáncer de células claras, variante de células granulares y la variante eosinófila de tipo papilar.
Tumores renales hereditarios
Pueden identificarse tumores renales hereditarios como parte de las siguientes entidades: síndrome de von Hippel-Lindau, papilar hereditario, síndrome de Birt-Hogg-Dube, leiomiomatosis hereditaria, esclerosis tuberosa y translocación constitucional del cromosoma 3.
- – Tumores mesenquimatosos: incluyen diferentes tipos de sarcomas y son relativamente raros, excepto el angiomiolipoma.
- – Angiomiolipoma: representa el 1% de los tumores extirpados, es benigno y está constituido por tejido adiposo, células musculares lisas fusiformes y epiteloides, y vasos sanguíneos de pared gruesa anómalos. Puede aparecer de forma esporádica, afecta hasta cuatro veces más a la mujer; cuando se presenta en esclerosis tuberosa, suele ser múltiple, bilateral, de mayor tamaño y con probabilidad de causar hemorragias espontáneas.
Otras afecciones histológicas10
- – Tumor/carcinoma folicular pseudotiroideo del riñón
- – Cáncer renal asociado a neuroblastoma
- – Tumor angiomioadenomatoso renal
- – Carcinoma tubuloquístico
- – Cáncer renal papilar de células claras
- – Cáncer renal papilar oncocítico
- – Carcinoma renal folicular
- – Cáncer renal leiomiomatoso
Tratamiento quirúrgico
Debido a la escasez de marcadores bioquímicos, los estudios de imagen son determinantes en la sospecha diagnóstica y sobre la estirpe. Es imperativo realizar histopatología e inmunohistoquímica del producto del procedimiento quirúrgico (nefrectomía parcial, nefrectomía radical, suprarrenalectomía, linfadenectomía o embolización, el que sea considerado en cada caso) (Fig. 2)11–13.
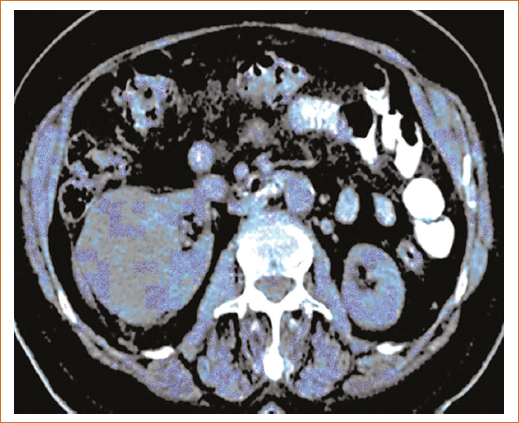
Figura 2. Tomografía axial computarizada renal.
En la figura 2 se identifica masa renal lobulada de grandes dimensiones a expensas de la corteza renal.
- – Criterios para nefrectomía parcial:
- • Absolutos: un solo riñón anatómico o funcional.
- • Relativos: el riñón contralateral funcionante se encuentra afectado por un proceso que podría deteriorar la función renal en el futuro.
- • Optativos: cáncer renal unilateral localizado con riñón contralateral sano.
- – Nefrectomía radical laparoscópica.
- – Técnicas percutáneas: ablación por radiofrecuencia percutánea, crioablación, ablación con microondas, ablación con láser y ablación con ultrasonidos centrados de alta intensidad.
Entre las contraindicaciones de los procedimientos mencionados destacan esperanza de vida reducida a menos de un año, metástasis múltiples y baja posibilidad de éxito del tratamiento debido al tamaño o localización del tumor11–13.
Tratamiento adyuvante
Tratamiento conservador basado en cuidados paliativos dirigidos a las necesidades de cada paciente14,15.
- – Inmunoterapia o terapia biológica:
- • Nivolumab, pembrozilumab, atezalizumab, ipilumumad.
- • Interferón e interleucina. Efectos renales: proteinuria, nefritis intersticial aguda, lesiones glomerulares diversas.
- – Nuevos fármacos:
- • Inhibidores de mTOR: everolimús, temsirolimús. Efectos renales: proteinuira, alteraciones electrolíticas, lesión renal aguda.
- • Inhibidores de la tirosina cinasa anti-VEGF, anti-VEGFr (sunitinib, axitinib, aflibercept, bevacizumab, sorafenib, pazopanib). Efectos renales: hipertensión arterial, proteinuria, lesión renal aguda, litiasis renal.
Incidencia de enfermedad renal crónica tras una nefrectomía
Hasta el 22% de los pacientes con tumores renales previos a la nefrectomía tienen una disminución del filtrado glomerular, lo cual sobreestima la frecuencia de enfermedad renal crónica1. Las dos opciones quirúrgicas nefrectomía radical o nefrectomía parcial no se diferencian en términos de evolución oncológica, pero sí en la incidencia postoperatoria de ERC y complicaciones cardiovasculares. Se sugiere actualmente que la nefrectomía parcial es un estándar de tratamiento para tumores de 4 cm o menores (T1a) y una opción viable para pacientes con tumores mayores de 4 y de hasta 7 cm (T1b)13,14.
En un metaanálisis de 32,057 participantes no se observó asociación entre ERC y el riesgo de cáncer, aunque sí encontró una evidencia de mayor asociación entre los pacientes en diálisis y la presencia de determinados tipos de cáncer (urinario, endocrino y digestivo)15.
La prevalencia de cáncer en pacientes trasplantados es muy superior en la actualidad, debido a que se trasplanta a población de edad avanzada, y esto constituye un factor determinante. Los datos del registro ANZDATA (Australia y Nueva Zelanda) muestran que en los últimos años, el cáncer se ha convertido en una causa de mortalidad tan frecuente como la de origen cardiovascular en la población trasplantada renal16,17.
Otros problemas oncohematológicos, su relación con la enfermedad renal y las terapias sustitutivas
Síndrome de lisis tumoral
Es una emergencia hematooncológica que se produce por la muerte de células tumorales, la cual puede ocurrir de manera espontánea o ser inducida por el suministro de la quimioterapia. El riesgo de sufrir lisis tumoral depende de varios aspectos, tipo de tumor, carga tumoral, las características del paciente y el tipo de terapia. Existen parámetros bioquímicos que orientan el diagnóstico, destacan los trastornos electrolíticos, afección de la función renal y la concentración de ácido úrico sérico. El uso de rasburicasa es un tratamiento eficaz.
Tratamiento extracorpóreo para el manejo de la nefropatía por cilindros del mieloma múltiple
En estos pacientes se deben medir los niveles séricos de cadenas ligeras libres en suero, estas se asocian con una menor supervivencia. El tratamiento de soporte y la quimioterapia deben iniciarse siempre lo antes posible, antes que la plasmaféresis terapéutica o la hemodiálisis con dializadores de poro grueso (high cut-off hemodialysis); esta intervención también es útil para la eliminación de otros agentes citotóxicos y sustancias analgésicas.
Manejo de la enfermedad ósea relacionada con el mieloma múltiple
De manera general se acepta que los bisfosfonatos están contraindicados en pacientes con enfermedad renal avanzada, sin embargo, el pamidronato en monodosis (30 mg) no requiere ajuste de dosis con TFG superior a 30 ml/min por 1.73 m2. Esta molécula puede usarse en pacientes con hemodiálisis.
Áreas de investigación prometedoras en pacientes específicos:
- – Quimioterapia para el tratamiento de la gammapatía monoclonal.
- – Candidatos a trasplante renal en pacientes con mieloma múltiple y amiloidosis en diálisis.
- – Dosis de agentes citotóxicos en pacientes con ERC G3b-G5D.
- – Papel de las nuevas «terapias adsorbentes» en pacientes de hematología/oncología
- – Determinar qué pacientes con cáncer hematológico y ERC deben recibir agentes estimulantes de la eritropoyesis.
- – Toma de decisiones para iniciar o suspender el tratamiento sustitutivo renal.
Cáncer en pacientes con trasplante renal
Los diversos reportes que existen en la literatura demuestran un incremento de dos hasta diez veces la posibilidad de desarrollar tumores y cánceres en pacientes con trasplante renal, inclusive algunos tipos alcanzan cifras de hasta 20 veces, lo cual supone una vigilancia estrecha en el postrasplante, tanto de donadores como receptores; y más aún, apego estricto a lo establecido en la literatura para el estudio del donado y receptor de órgano renal (Tabla 3)15,16.
Tabla 3. Tiempos de espera recomendados para cirugía de trasplante
| Contraindicación absoluta |
| Neoplasias malignas activas no controladas o no tratadas |
| 5 años de espera |
| Cáncer de mama estadio II |
| Cáncer de cuello uterino extenso y no in situ |
| Cáncer colorrectal estadio C |
| Melanoma |
| Cáncer renal invasivo o sintomático |
| 2 años de espera |
| Cáncer de vejiga invasivo |
| Cáncer de mama in situ |
| Melanoma in situ |
| Cáncer cervical localizado |
| Cáncer colorrectal estadio A y B1 |
| Linfoma Hodgking y no Hodgking |
| Leucemia |
| Cáncer pulmonar |
| Cáncer prostático |
| Cáncer testicular |
| Cáncer tiroideo |
| Tumor de Wilms (1 año de espera es aceptable) |
| Síndrome proliferativo postrasplante |
| Sin tiempo de espera |
| Cáncer de vejiga superficial |
| Carcinoma de células basales no metastásico |
| Cáncer prostático (focal, localizado, Gleason < 3 puntos, T1a, T1c) |
| Carcinoma renal incidental significado incierto |
| Gammapatía monoclonal |
Recientemente existen nuevas recomendaciones para el tratamiento del cáncer renal localizado basado en radioterapia corporal estereotáxica18–20. La Asociación Europea de Urología ha implementado guías para el tratamiento del cáncer renal en las cuales de manera general el abordaje del cáncer renal estará basado en obtener un diagnóstico histopatológico específico, en donde la biopsia renal percutánea desempeña un papel determinante, el tratamiento quirúrgico localizado será la preferencia y cuando sea necesario, realizar la disección de nódulos linfáticos, manejo de trombosis venosa y sistémica, y manejo integral de las metástasis21,22.
Financiamiento
Los autores declaran que este trabajo se realizó con recursos propios.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.
